تئوری
پیش از پرداختن به مبحث تهیه صابون در آزمایشگاه شیمی آلی خوب است بدانیم ساختار صابون بهصورت CH3-(CH2)n-COO– +X است که برای صابونهای جامد، یون سدیم بجای X قرار میگیرد و برای صابونهای مایع از پتاسیم و آمونیوم استفاده میشود.
در این آزمایش، یون هیدروکسید باز که یک هسته دوست یا همان نوکلئوفیل است به کربونیل حمله میکند و با خروج یک مولکول الکل، آنیون اسید به شکل هیبرید رزونانس، پایدار میشود.
نکته: نقش الکل در اینجا به عنوان حلال است.
آشنایی با دلایل انتخاب انواع مواد اولیه برای سنتز صابون در آزمایشگاه
مواد اولیه و دلایل انتخاب آنها برای تولید صابون به شرح زیر است.
- چربی که مولکول آلی و نامحلول در آب است.
- ترکیبات قلیایی مثل سود که محلول در آب هستند.
- الکل که به عنوان حلال است.
نقش الکل در تهیه صابون
علت استفاده از الکل آن است که برای انجام واکنش بین چربی و ترکیب قلیایی باید از حلالی استفاده شود که بتواند هر دو ماده اولیه را در خود حل کند. به عنوان مثال الکلی مثل C2H5OH که دارای یک سر هیدروکربنی و یک سر قطبی است برای این آزمایش بسیار مفید میباشد.
علت استفاده از نمک
- علت استفاده از نمک آن است که یون سدیم با هیدروژنهای اسیدی جایگزین شود. محلول اشباع NaCl طبق اصل لوشاتلیه، کاتیونهای لازم جهت انجام واکنش را فراهم میکند و از تعویض یونها اطمینان حاصل میگردد.
- دومین علت استفاده از نمک در ساخت صابون، جهت جداسازی گلیسیرین است. به علت اینکه در صابون ساخته شده از گلیسیرین استفاده میشود بوی چربی زیادی میدهد. اگر بخواهید این ترکیب را جدا کنید باید پیش از آنکه در قالب بریزید صابون را یک شبانهروز در محلول اشباع NaCl بگذارید. پس از 24 ساعت آن را از ظرف خارج و بشوئید و به قطعات کوچک تقسم کنید و اجازه دهید در هوا خشک شود.
✔ بیشتر بخوانیم: آموزش نحوه نوشتن گزارش کار آزمایشگاه شیمی، فیزیک و…

مکانیسم تهیه صابون در آزمایشگاه به صورت تئوری
پیش از پرداختن به شرح آزمایش خوب است بدانید که در اصطلاح به هیدرولیز چربی یا روغن، صابونی کردن میگویند.
در عمل صابونی کردن (تهیه صابون در آزمایشگاه شیمی آلی)، ابتدا چربی (ترکیب a در تصویر زیر) را با محلول سود (NaOH) حرارت میدهند که حاصل آن، گلیسیرین یعنی ترکیب b و مخلوطی از سدیم اسیدهای چرب (ترکیب C) به دست میآید.
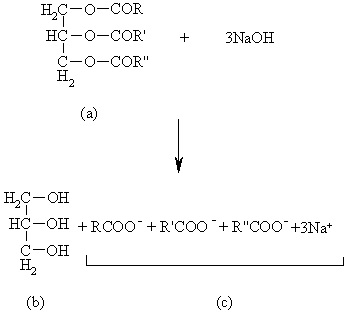
چربیها و روغنها در حالت کلی دارای ساختار a هستند. در واقع چربیها و روغنهای طبیعی، استر اسیدهای آلیفاتیک یک ظرفیتی با تعداد اتمهای کربن زوج و گلیسیرین هستند که به آنها گلیسیرید میگویند.
نقطه ذوب چربیها که ترکیباتی جامد هستند بالاتر از نقطه ذوب روغنها که به شکل مایع هستند میباشد. علت تفاوت نقطه ذوب نیز آن است که هر چه مقدار اسیدهای اشباع نشده در ساختار چربی بیشتر باشد نقطه ذوب کمتر میشود. پس میتوان گفت این تفاوت دمایی به نوع و میزان اسید بستگی دارد.
جالب است بدانید پی گوسفند به علت اینکه فقط از اسیدهای اشباع ساخته شده است نقطه ذوب زیادی دارد.
روغنهای زیتون، روغن نارگیل، کرچک و خرما، اسیدهای چرب (اولئیک، استئاریک و پالمیتیک) و اسیدهای غیراشباع با چند پیوند 2گانه مثل لینولئیک دارند. (فرمول زیر)
در ادامه، مکانیسم هیدرولیز استر در محیطهای قلیایی را میبینیم:
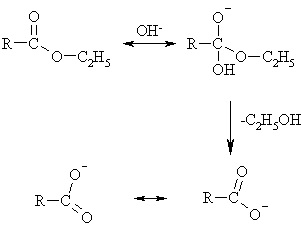
همانطور که در بالا میبینم، یون هیدروکسید یک هسته دوست است که ابتدا به کربن گروه کربونیل حمله میکند. سپس با خروج یک الکل، آنیون اسید بهصورت هیبرید رزونانس فوق پایدار میگردد.
✔ بیشتر بخوانیم: اصول ایمنی در آزمایشگاه شیمی یا هر آزمایشگاه دیگری!
سنتز صابون به صورت عملی (روش 1)
- 50 گرم چربی را در یک بشر با حجم 250 میلی لیتر بریزید.
- محتویات بشر را حرارت دهید تا ذوب شود. (نکته: دما را چک کنید که بالاتر از 70 درجه سانتیگراد نرود.)
- همزمان با حرارت دادن چربی و هم زدن پیوستة این ترکیب، نوبت به اضافه کردن محلول سود (7گرم در 50 میلی لیتر آب) است.
- برای افزودن سود به این ترکیب باید ابتدا 5 میلی لیتر از آن را اضافه کنید. سپس هنگامیکه تقریبا تمام سود مصرف شد، 5 میلی لیتر بعدی را بیافزایید. (نکته: جهت مطمئن شدن از میزان مصرف سود، باید نوک اسپاتول را در بشر ببرید و 1 قطره فنل فتالئین روی آن بریزید. اگر سریعا رنگ آن به ارغوانی تغییر کرد نشان دهنده آن است که همچنان سود وجود دارد و باید کار همزدن ترکیب را ادامه دهید.)
- هنگامیکه آخرین مرحله ریختن سود را انجام دادید باز هم کار همزدن را متوقف نکنید و این کار را تا جایی که صابون کشدار شود (استشام بوی صابون) ادامه دهید.
- صابون را در قالب بریزید و اجازه دهید 7 روز بماند.
- حال صابون شما دارای مقدار زیادی گلیسیرین است که برای جدا کردن آن باید مراحلی که در بالاتر توضیح دادیم را انجام دهید.
✔ بیشتر بخوانیم: خرید بشر آزمایشگاهی
سنتز صابون به صورت عملی ( روش 2)
- 50 سی سی روغن مایع و 40 سی سی اتانول و 3 گرم پتاسیم هیدروکسید را در یک بالن بریزید و نیم ساعت رفلاکس کنید.
- پس از تمام شدن رفلاکس، چند قطره از مخلوط را در کمی آب بریزید و آن را حل کنید. علت انجام این کار آن است که نشان دهنده اتمام واکنش است. در صورتیکه قطره روغنی روی آب نباشد یعنی کار ما در اینجا به پایان رسیده است اما اگر قطره روغن را دیدید یعنی باید 15 دقیقه دیگر رفلاکس را انجام دهید.
- حال باید الکل موجود را توسط تقطیر ساده جدا کنید و ماده باقیمانده در بالن را به 75 سی سی آب مقطر گرم اضافه و حل کنید.
توجه: حتما باید الکل موجود در بالن از مخلوط خارج گردد سپس ادامه آزمایش که به شرح زیر است را انجام دهید.
- آهسته آهسته، 25 میلی لیتر محلول حاصله را به 25 میلی لیتر آب نمک اشباع اضافه کنید.
- مخلوط را صاف کنید تا صابونی که ساخته شده روی کاغذ صافی بماند.
- آن را با آب نمک اشباع بشوئید و صابون را در یک ظرف شیشه ای بریزید.
- به 10 میلی لیتر صابون، 10 میلی لیتر آب شهر اضافه کنید.
حال شما در کامنتهای این مقاله نتیجه انجام این آزمایش را برای دوستانتان بنویسید.
https://www.rsc.org/suppdata/c7/rp/c7rp00133a/c7rp00133a2.pdf