هر فردی که در آزمایشگاه شیمی قدم بگذارد، از همان روزهای اول با محلول سازی سروکار دارد و برای آزمایشات بسیاری باید محلول هایی با غلظت مشخص تهیه کند. اما شاید این سوال برای شما پیش آید که محلول سازی چیست؟
در پاسخ به این پرسش باید یگوییم که به حل شدن یک حل شونده که به شکل جامد یا مایع یا گاز است در یک حلالِ مایع را محلول سازی میگویند.
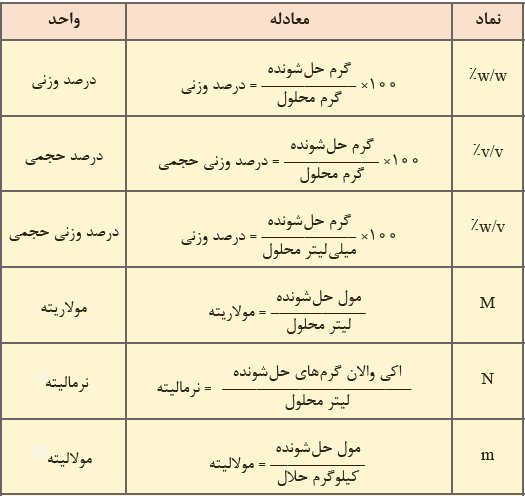
پیش از هر چیز، در ابتدای مقاله در جدول زیر متداولترین و کاربردیترین واحدهای مورد استفاده برای بیان غلظت محلول را آوردیم تا یک دید کلی برای ادامه مقاله داشته باشید.
بسیاری از واکنشها از جمله واکنش تیتراسیون، خنثی شدن، اکسایش- کاهش و… به شکل محلول انجام میگیرند و نیاز به محلول سازی دارند. بنابراین محاسبات کمی آنها بر اساس غلظت است و مقدار دقیق حل شونده در حلال باید مشخص باشد.
تعریف محلول، حلال، حل شونده و انحلال پذیری
پیش از هر چیز خوب است ابتدا به تعریف محلول، حلال، حل شونده و انحلال پذیری بپردازیم.
- محلول ها مخلوط های همگنی هستند که حاصل از حل شدن 1 یا 2 حل شونده در حلال می باشند و به 3 دستهی جامد، مایع و گاز تقسیم می شوند. البته یک تقسیم بندی دیگر نیز برای محلول ها وجود دارد که آنها را به محلول های غلیظ، رقیق،محلول سیر شده، محلول سیر نشده و فراسیر شده دسته بندی میکند.
- جزئی از یک محلول که اندازه آن بیشتر از سایر اجزای محلول باشد، حلال نام دارد.
- جزئی از یک محلول که اندازه آن کمتر از سایر اجزای محلول باشد، حل شونده نام دارد.
- بیشترین مقدار حل شونده که در مقدار معینی حلال، حل شود و سیستم پایداری بسازد را انحلال پذیری میگویند.

تعریف تئوری محلول سازی
اگر بخواهیم در ابتدا به طور تئوری به محلول سازی بپردازیم باید بگوییم که برای این کار نیاز به نمونه جامد یا مایع داریم که توسط معادلات و روابط شیمیایی در آزمایشگاه بتوانیم محلول موردنظر را با غلظت مشخصی بسازیم.
👈 شیمی آلی چیست؟ | کاربرد شیمی آلی، اصطلاحات آن و…
روش های محلول سازی در آزمایشگاه
در حالت کلی روش های محلول سازی در آزمایشگاه به 2 صورت است.
- محلول سازی از مایعات
- محلول سازی از جامدات (یک روش محلول سازی که نسبت به مایعات راحتتر است.)
👈 تهیه صابون در آزمایشگاه شیمی آلی (آزمایش صابونی شدن به 2 روش)

وسایل مورد نیاز و نکات محلول سازی از جامدات
در ابتدا باید بگوییم برای محلول سازی با جامدات نیاز به وسایل زیر داریم.
- شیشه ساعت
- بالن ژوژه
- بشر
- همزن شیشه ای
- اسپاتول
- پیست حاوی آب مقطر
برای انجام این کار توجه به نکات زیر ضروری است.
نکته 1: جهت آماده سازی مواد برای محلول سازی از جامدات، باید وزن کردن مواد جامد را بر روی یک سطح صاف مثل پتری یا یک کاغذ تمیز و صاف انجام دهید.
نکته 2: هنگامیکه آن را روی ترازو گذاشتید دستگاه را صفر کنید و یا وزن کل آن را از وزن ظرف یا کاغذ کم کنید.
نکته 3: همیشه به اندازه نیاز از مواد را بردارید تا مجبور نشوید با برگرداندن ماده اضافه به ظرف اصلی باعث آلودگی کل نمونه شوید.
نکته 4: حتما از قاشقک تمیز استفاده کنید.
روش محلول سازی از جامدات
- اولین مرحله در محلول سازی با غلظت مشخص، پیدا کردن مقدار و وزن حل شونده طبق فرمول محلول سازی است.
غالبا تهیه محلول با غلظت معلوم از فرمولهای غلظت معمولی، مولاریته، مولالیته و یا نرمالیته بدست می آید. البته این نکته را نیز باید بگوییم که گاهی نیز ساخت محلولها با درصد جرمی (W/W)، درصد حجمی- حجمی (V/V) و یا درصد وزنی- حجمی (W/V) انجام می پذیرد.
نکته1: درصد وزنی- حجمی را به اختصار درصد وزنی می گویند.
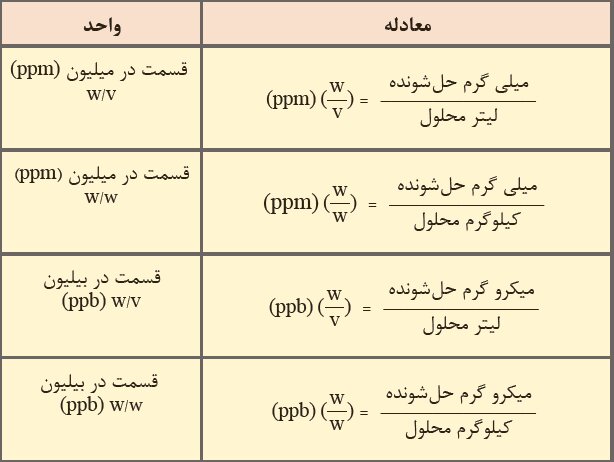
نکته2: واحد غلظت برای محلولهای خیلی رقیق ppm یا ppb است.
- در مرحله بعدی، پس از وزن کردن نمونه جامد، آن را در بالون ژوژه بریزید.
- کمی حلال به بالن اضافه کنید و آن را کامل تکان دهید تا حل شونده در حلال حل شود.
- باقیمانده حلال را به محلول اضافه کنید تا به خط نشانهی بالن ژوژه برسد.
تهیه محلول به کمک درصد وزنی (W/V)
برای تهیه محلول با درصد وزنی- حجمی باید جرم حل شونده (به گرم) را بر حجم محلول (بر حسب میلیلیتر) تقسیم کنید و در آخر ضربدر عدد 100 نمایید تا درصد آن به دست آید.
۱۰۰ × (حجم محلول برحسب میلیلیتر / جرم حلشونده برحسب گرم) = فرمول درصد وزنی
مثال: محلول 10 درصد نمک طعام دارای 10 گرم NaCl حل شده در 100 ml محلول است که در زیر نحوه تهیه این محلول را شرح می دهیم.
روش تهیه محلول NaCl به صورت درصد- وزنی
- 10 گرم نمک NaCl را وزن کنید.
- آن را در یک بالن حجمی یا استوانه مدرج بریزید.
- آب مقطر بدان بیافزایید و شروع به همزدن کنید تا نمک به طور کامل حل شود.
- حال محلول را با کمک آب مقطر به حجم 100 ml برسانید.
نکته مهم: هیچگاه نباید پودر را در 100 میلی لیتر آب حل کنید.

وسایل مورد نیاز و نکات محلول سازی از مایعات
پیش از پرداختن به این موضوع خوب است بدانید که برای اندازهگیری حجم مایعات از ظروف آزمایشگاهی شیشه ای مدرج استفاده میشود بنابراین برای بالا بردن دقت آزمایش بهتر است که از ظروف با کیفیتی که درجهبندی دقیقی دارند استفاده نمایید.
برای محلول سازی با مایعات نیاز به وسایل زیر داریم.
- بشر
- بالن ژوژه
- پیپت
- استوانه مدرج
- پیست حاوی آب مقطر
روش محلول سازی از مایعات به روش وزنی
مراحل محلول سازی از مایعات به روش وزنی بهصورت زیر است.
- بشر را روی ترازو بگذارید و آن را صفر کنید.
- اندازهی حل شونده را که طبق فرمول بدست آوردید وزن کنید و در بالن بریزید.
- توسط حلال، حجم را به حجم موردنظر برسانید.
👈 آشنایی با انواع ظروف آزمایشگاهی (25 ظرف آزمایشگاه!)
روش محلول سازی از مایعات به روش حجمی
- طبق محاسباتی که انجام دادید، توسط یک پیپت از محلول اولیه، حل شونده را بردارید و در بالن بریزید.
- توسط حلال، حجم محلول را به خط نشانه بالن برسانید.

محلول سازی از محلول های غلیظ آزمایشگاه
غالباً در آزمایشگاهها از محلولهای استاندارد که به شکل غلیظ و با درصد خلوص مشخصی هستند برای ساخت محلولهای رقیق استفاده میکنند. زیرا در محلولهای استاندارد مقدار ماده حل شونده و حلال یا مقدار ماده حل شده و محلول مشخص است و این کمک میکند که غلظت محلول بدست آید.
👈 نحوه شستشوی ظروف آزمایشگاهی {از ظروف نو تا ظروف شیمی آلی}
رقیق سازی
برای رقیق سازی نیاز به درصد خلوص، دانسیته و همچنین جرم مولکولی محلول مادر (محلول استاندارد) دارید.
فرمول رقیق سازی بهصورت زیر است.
CM=10ad/M
- در این فرمول باید بجای CM مقدار مولاریته محلول استاندارد را قرار دهید.
- بجای M در مخرج کسر، جرم مولکولی را بگذارید.
- بجای a درصد خلوص و بجای d چگالی یا دانسیته را قرار دهید.
در واقع، در این روش، برای بدست آوردن یک محلول با غلظت و حجم مدنظر، از یک محلول غلیظ با استفاده از فرمول غلظت و اضافه کردن آب آن را تهیه میکنند.
بهعنوانمثال یک اسید قوی را در نظر بگیرید. برای محلول سازی از فرمول رقیق سازی باید کمک بگیرید که این رقیق سازی یا بهصورت درصدی است و یا به شکل غلظتی که در ادامه به توضیح هر یک از آنها میپردازیم.
👈 تشخیص انواع الکل از یکدیگر + روش تشخیص الکل اصلی و تقلبی

-
رقیق سازی به شکل درصدی
در این روش، طبق فرمول زیر قادر خواهید بود که با استفاده از یک محلول غلیظ یا محلول استاندارد با درصد جرمی یا درصد خلوص معین، یک محلول جدید با درصد جرمی یا خلوص متفاوت از محلول غلیظ بسازید.
(درصد محلول مادر / درصد محلول مورد نیاز) × مقدار مورد نیاز از محلول بر حسب میلیلیتر
تمرین محلول سازی:
450 ml محلول اسید سولفوریک 85 درصد تهیه کنید.
حل تمرین:
ازآنجا که محلول غلیظ اسید سولفوریک 98 درصد است پس:
450 ml × (85% / 98%) = C = 4 g / 0.5 L= 390.3 ml
390.3 /100 = 3.390
همانطور که در فرمول بدست آمد، باید 3.390 میلیلیتر از اسید سولفوریک غلیظ را برداشته و به حجم ۴۵۰ میلیلیتر برسانید.
-
رقیق سازی به صورت غلظتی
در این روش، از این نکته کمک میگیریم که تعداد مول حل شونده در محلول غلیظ و رقیق تفاوتی با یکدیگر ندارد و با استفاده از این تساوی میشود مجهول را به دست آورد.
در واقع با 4 فرمول زیر که برای 4 حالت مختلف است می توان از یک محلول با غلظت معین به یک محلول جدید با غلظتی متفاوت رسید.

الف: حالتی که 2 محلول یکدیگر را خنثی کنند
N۱ × V۱ = N۲ × V۲
N۱: نرمالیته محلول اول
V۱: حجم محلول اول بر حسب لیتر
N2: نرمالیته محلول دوم
V2: حجم محلول دوم بر حسب لیتر
این رابطه را میتوان بر حسب غلظت معمولی (C) یا مولاریته (M) نیز بهصورت زیر نوشت.
M۱ × V۱ = M۲ × V۲
C۱ × V۱ = C۲ × V۲
نکته: اگر در یک طرف فرمول، واحد حجم را لیتر یا میلیلیتر گرفتید در طرف دیگر نیز باید همان واحد را در نظر بگیرید.
ب: در حالتی که دو محلول استفاده شده به طور کامل همدیگر را خنثی نکنند
در اینجا نرمالیته محلول جدید با فرمول زیر (فرمول نرمالیته) بدست می آید.
N = (N1V1 – N2V2) / (V1+V2)

ج: در حالتی که دو یا چند محلول که با یکدیگر استفاده شدند هم جنس باشند
نرمالیته محلول جدید را طبق فرمول زیر محاسبه میکنند.
N = N1V1 + N2V2 + N3V3 +… / V1 + V2 + V3 + …
د: در حالتی که محلول را توسط آب مقطر رقیق کنید
در اینجا نرمالیته محلول جدید با فرمول زیر بدست میآید.
N۱ × V۱ = N × (V۱ + VH2O)
N۱: نرمالیته محلول اول
V۱: حجم محلول اول بر حسب لیتر
N: نرمالیته محلول جدید
VH2O: حجم آب مقطر
محلول ساختن بهصورت نسبت
گاهی لازم است در آزمایشات خود محلول سازی را بر اساس یک نسبت معین بسازید.
مثال: فرض کنید میخواهید محلول 2 به 1 اسید استیک را بسازید. در اینجا باید به ازای هر میلی لیتر از اسید استیک، 2 میلی لیتر آب مقطر با توجه به حجم محلول مورد نیازتان بیافزایید.

فرمول محلول سازی
فرض کنید میخواهید شکر را در آب حل کنید. پس ابتدا شکر را در آب میریزید و آن را هم میزنید تا حل شود. از یک مرحله به بعد هر چقدر محلول را هم میزنید دیگر شکر در آن حل نمیشود و ته نشین میگردد. در اینجا مقدار شکری که در کف ظرف باقیمانده حلالیت آن است. پس میتوان گفت حلالیت یعنی حداکثر میزان املاح که میتواند در یک مقدار معین حلال و در یک دمای خاص حل شود.
حلالیت به عواملی مثل انواع املاح و حلال، فشار و دما وابسته است.
S = √Ksp
در معادله بالا Ksp ثابت حاصلضرب حلالیت نام دارد.
درصورتیکه انحلال گرماگیر باشد با افزایش دما، حلالیت افزایش میباید.
به دلیل اینکه جامدات خیلی تراکمناپذیر هستند، فشار روی محلولهای جامد در مایعات خیلی تأثیر ندارد.
https://study.com/academy/lesson/solubility-in-chemistry-definition-properties-quiz.html